Centro de recursos


Esa pastillita que tomaste esta mañana ha sobrevivido a un viaje épico. Puede tomar más de una década y miles de millones de dólares para que un nuevo medicamento recetado viaje desde su formulación inicial, a través de pruebas, revisiones de la FDA (Administración de Medicamentos y Alimentos) y llegue hasta tu casa. Este es uno de los procesos de aprobación más rigurosos para un producto de consumo en el mundo, diseñado para garantizar los más altos niveles de seguridad y eficacia.
Pero hay algo sorprendente. Una vez que un medicamento por fin es aprobado para un uso específico, puede ser recetado para diferentes enfermedades o dolencias, en diferentes dosis, a otros grupos de edad, según lo considere conveniente el médico. Y eso es lícito. A los médicos no se les exige que te informen que te están recetando medicamentos fuera de las pautas de la FDA (una práctica llamada "off-label prescribing" o prescripción para usos no indicados en la etiqueta).


Membresía de AARP: $15 por tu primer año cuando te inscribes en la renovación automática.
Obtén acceso inmediato a productos exclusivos para socios y cientos de descuentos, una segunda membresía gratis y una suscripción a AARP The Magazine.
Únete a AARP
Esta no es una práctica insignificante. Un estudio del 2006 (uno de los pocos realizados sobre el tema) informó que alrededor del 21% de las prescripciones que los médicos en consultorios escribieron para medicamentos comúnmente recetados eran para usos no indicados en la etiqueta. Hoy en día, la prescripción para usos no indicados en la etiqueta es una práctica habitual para muchos médicos. Organizaciones como la American Medical Association (AMA, Asociación Americana de Medicina) y la American Psychiatric Association (APA, Asociación Estadounidense de Psiquiatría) apoyan firmemente la práctica y afirman la capacidad de los médicos para recetar medicamentos para usos no indicados en la etiqueta cuando se basan en evidencia científica sólida o en una opinión médica sólida.
Más recursos
- En DailyMed.nlm.nih.gov (en inglés) puedes consultar si los medicamentos que tomas están indicados para tu enfermedad o trastorno. Ingresa el nombre del medicamento, selecciona el tipo de medicamento que estás tomando (píldora, líquido), luego haz clic en Indications and Usages (Indicaciones y usos) para ver si tu diagnóstico aparece en la lista. Si tienes preguntas, consulta a tu médico o farmacéutico.
- En OpenPaymentsData.cms.gov (en inglés) puedes consultar si tu médico u hospital universitario ha recibido dinero o algo de valor de una compañía farmacéutica.
Pero el uso de medicamentos fuera de las indicaciones autorizadas es complejo, en parte porque hay muy pocos datos reportados sobre esta acción. Rara vez se realizan estudios para ver si los medicamentos que no están en la etiqueta coinciden con los medicamentos aprobados por la FDA en efectividad o si hay efectos secundarios adicionales.
David Cavalla, autor del libro del 2014 Off-Label Prescribing: Justifying Unapproved Medicine, es muy crítico de esta práctica. "Aunque las autoridades reguladoras son muy estrictas en cuanto a las normas de fabricación y la documentación que respalda los medicamentos que tomamos, no regulan la forma en que se prescriben", afirma. "Este es un escándalo serio en el núcleo de nuestro sistema de salud, una ofensa al principio de la medicina basada en la evidencia".
Lo que es seguro es que la prescripción para usos no indicados en la etiqueta es altamente lucrativa para la industria farmacéutica. Mientras que a los fabricantes se les prohíbe en gran medida promover sus medicamentos para usos no indicados en la etiqueta, eso no parece que los haya detenido por completo. Según un informe del 2018, entre el 2004 y el 2017 las compañías farmacéuticas pagaron más de $11,000 millones en sanciones financieras penales y civiles por promoción ilícita, incluidos los usos no indicados en la etiqueta del medicamento. La histórica decisión de la corte de Oklahoma a finales de agosto, en la que se multó a Johnson & Johnson por $572 millones, se relacionó en parte con la intensa comercialización de opiáceos.
Esto es lo que necesitas saber sobre la práctica y el papel que desempeña la industria farmacéutica.
¿Qué es el uso no indicado en la etiqueta?
El uso de un medicamento se considera "no indicado en la etiqueta" no solo cuando se prescribe para una enfermedad o trastorno que no está aprobado para tratar, sino también cuando se administra a un grupo de edad, o en una dosis diferente, o por un período de tiempo superior a los parámetros de la FDA (en inglés).
El uso de medicamentos para tratamientos no indicados en la etiqueta es particularmente frecuente en la pediatría y geriatría (ya que menos ensayos clínicos involucran a menores de 18 o mayores de 65 años), oncología (donde los cánceres en etapa terminal requieren tratamientos más riesgosos) y salud mental (debido a que muchos trastornos psiquiátricos carecen de un tratamiento farmacológico oficial). También hay miles de enfermedades raras para las que hay pocas opciones medicinales.
Tomemos el caso de Lisa Rosendahl, a quien a los 21 años se le diagnosticó un tumor cerebral poco común. Rosendahl se sometió a años de radiación y quimioterapia, y a diez operaciones. Tenía sus altibajos, pero el tumor era persistente. Jean Mulcahy Levy, neurooncólogo pediátrico del Children’s Hospital de Colorado, sugirió tratarla con una combinación de medicamentos para usos no indicados en la etiqueta, como la cloroquina, un medicamento antipalúdico que existe desde 1934. Esta combinación de medicamentos se había usado solo en otro caso de tumor cerebral de esta manera y, por supuesto, no fue aprobada por la FDA, pero se había mostrado prometedora en experimentos de laboratorio.
"Lisa iba cuesta abajo y probablemente solo habría durado unos pocos meses más", cuenta su padre, Greg Rosendahl, un capitán de aerolínea jubilado, de 70 años, que vive en Boulder, Colorado. "Así que decidimos intentarlo, y tuvo un efecto drástico. Funcionó tan bien que Lisa pudo volver a la universidad y empezar a mirar hacia el futuro. Fue maravilloso verla feliz y enérgica de nuevo".
Finalmente, el cáncer comenzó a crecer de nuevo; Rosendahl murió a los 26 años, en el 2017. Pero su médico señala que los pacientes con su tipo de tumor suelen vivir tan solo catorce meses. Rosendahl sobrevivió durante años, en parte debido al uso de una combinación de medicamentos para usos no indicados en la etiqueta, afirma su médico.
La situación de Rosendahl era única, pero los medicamentos para usos no indicados en la etiqueta se prescriben a diario en la medicina convencional. Considera lo siguiente:
- La metformina es el fármaco de primera línea para la diabetes tipo 2; sin embargo, se ha utilizado más allá de lo indicado para la pérdida de peso, la salud cardíaca, el síndrome de ovario poliquístico e incluso posibles beneficios para la prevención del cáncer.
- Ciertos antidepresivos también están aprobados para el trastorno de estrés postraumático y el trastorno obsesivo-compulsivo, pero se prescriben para usos no indicados en la etiqueta, como los sofocos y la ansiedad generalizada. Un estudio realizado en el 2017 descubrió que, en Canadá, solo 1 de cada 6 recetas de antidepresivos para usos no indicados en la etiqueta estaba respaldada por evidencia científica sólida.
- El propranolol, un betabloqueante aprobado para tratar la presión arterial alta y las enfermedades cardíacas, se utiliza más allá de lo indicado en la etiqueta para reducir la ansiedad.
Entonces, ¿cómo es que los medicamentos legítimos como estos, aprobados para propósitos específicos, terminan siendo usados de manera tan diferente?
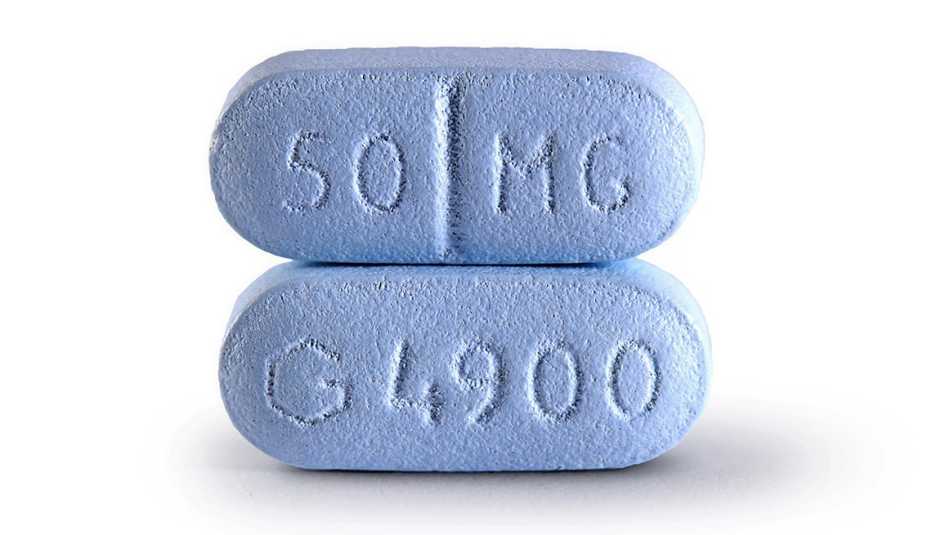
Medicamentos recetados para usos no indicados en la etiqueta


Metformina
Una marca común: Glucophage
Uso aprobado por la FDA: Mejorar el control glicémico en personas con diabetes tipo 2
Uso común no indicado en la etiqueta: Síndrome de ovario poliquístico
Fuentes: FDA, Prescribers’ Digital Reference



































.jpg?crop=true&anchor=13,195&q=80&color=ffffffff&u=lywnjt&w=2008&h=1154)


































También te puede interesar
10 medicamentos recetados con aumentos excesivos de precio
Estos medicamentos indispensables han incrementado sus precios por encima de la inflación.
Florida importará medicamentos recetados de Canadá
Esta aprobación de la FDA prepara el camino para medicamentos de menor costo.
Medicare gastó $180,000 millones en 10 medicamentos
Los 10 medicamentos están en la lista de la primera ronda de negociaciones de precios.