Centro de recursos
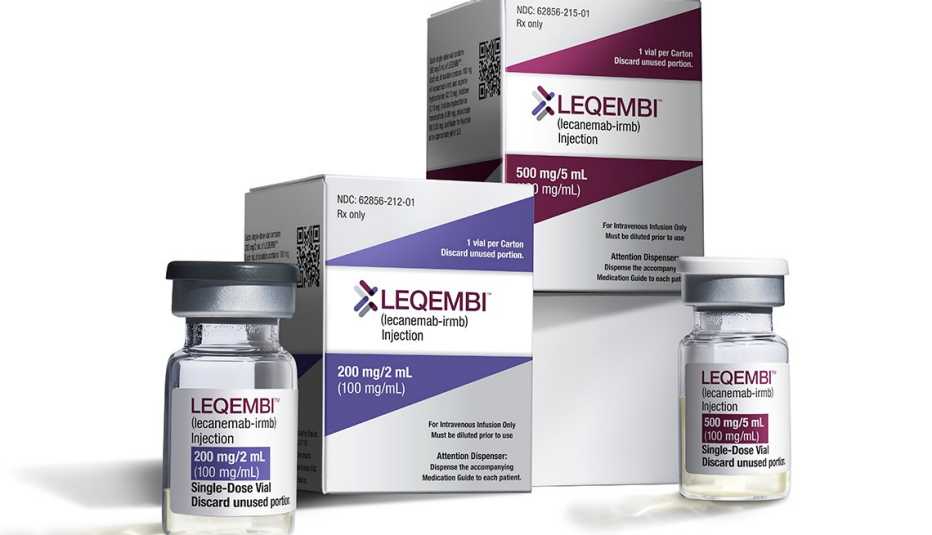
La Administración de Alimentos y Medicamentos (FDA) ha otorgado, por primera vez, la aprobación tradicional completa de un medicamento para la enfermedad de Alzheimer, diseñado para hacer más que tratar los síntomas de la enfermedad que afecta la memoria. El medicamento, lecanemab (nombre de marca Leqembi), demostró en ensayos clínicos que ayuda a frenar la progresión de la enfermedad de Alzheimer, para la que no existe cura, y que afecta a más de 6.5 millones de adultos mayores en Estados Unidos.
“Esto es muy importante”, dice el Dr. Ronald Petersen, director del Centro de Investigación de la Enfermedad de Alzheimer de Mayo Clinic. Aunque todavía queda trabajo por hacer en cuanto a encontrar medicamentos que puedan tratar la enfermedad de Alzheimer, dice, “hemos estado esperando este tipo de avance en el campo durante muchos, muchos años, y es un paso en la dirección correcta”.
La FDA otorgó al lecanemab lo que se conoce como aprobación acelerada en enero. Este proceso de aprobación de seguimiento rápido está reservado para medicamentos que tratan enfermedades graves y parecen prometedores según la evidencia preliminar. En junio, un comité de expertos que aconseja a la FDA votó a favor de aprobar por completo el lecanemab en función de los hallazgos clave de los datos amplios de sus ensayos clínicos en fase avanzada.
El medicamento, un anticuerpo monoclonal, redujo significativamente la cantidad de amiloide en el cerebro. (El amiloide, una proteína que se agrupa para formar placas que interrumpen la función celular, es un sello distintivo de la enfermedad de Alzheimer). También redujo la tasa de deterioro cognitivo —o la pérdida de las habilidades de pensamiento y memoria— en personas con la enfermedad de Alzheimer temprana o leve en un 27% durante un período de 18 meses.
Esencialmente, eso significa que el medicamento “puede preservar el nivel de función de la persona durante un período más largo”, dice Petersen. “No estás deteniendo la enfermedad, por lo que las personas en realidad no se quedan en su nivel exacto, pero progresan más lentamente”, agrega, y señala que esto podría ser especialmente útil para alguien en las primeras etapas de la enfermedad de Alzheimer que todavía puede trabajar, pagar las cuentas y vivir de manera independiente.
“La acción de hoy es la primera verificación de que un medicamento dirigido al proceso subyacente de la enfermedad de Alzheimer ha demostrado beneficios clínicos en esta devastadora enfermedad”, dijo Teresa Buracchio, directora interina de la Oficina de Neurociencia del Centro de Evaluación e Investigación de Medicamentos de la FDA en un comunicado de prensa.


Membresía de AARP: $15 por tu primer año cuando te inscribes en la renovación automática.
Obtén acceso inmediato a productos exclusivos para socios y cientos de descuentos, una segunda membresía gratis y una suscripción a AARP The Magazine.
Únete a AARP



































.jpg?crop=true&anchor=13,195&q=80&color=ffffffff&u=lywnjt&w=2008&h=1154)