Vida Sana

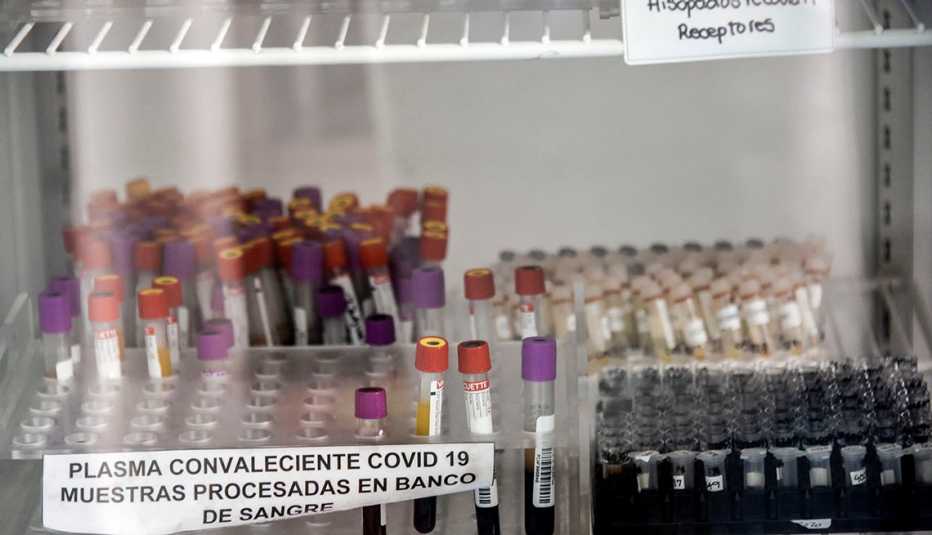
| La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) anunció el domingo que permitirá el uso de emergencia del “tratamiento con plasma de convaleciente” para pacientes hospitalizados con coronavirus, una medida que trajo esperanza y al mismo tiempo generó un debate.
El tratamiento, que consiste en inyectar el componente líquido de la sangre que contiene anticuerpos de personas que se han recuperado del coronavirus, se considera relativamente seguro. Los resultados iniciales de un estudio realizado por la Mayo Clinic mostraron que podría, en ciertas circunstancias limitadas y si se administra con suficiente anticipación, estimular el sistema inmunitario del organismo para combatir el virus.


Membresía de AARP: $12 por tu primer año cuando te inscribes en la renovación automática.
Obtén acceso inmediato a productos exclusivos para socios y cientos de descuentos, una segunda membresía gratis y una suscripción a AARP The Magazine.
Únete a AARP
Sin embargo, el estudio no ha concluido, y los datos publicados hasta el momento no cumplen con el estándar ampliamente establecido de una investigación doble ciega y revisada por expertos que incluya un grupo de control tratado con un placebo, tal como reconocieron prontamente los investigadores de Mayo. Específicamente, reportaron que el índice de mortalidad de siete días entre 35,000 pacientes —la mayoría gravemente enfermos— que recibieron la transfusión del tratamiento de plasma de convaleciente dentro de los tres días del diagnóstico de COVID-19 fue más bajo (8.7%) que el de los pacientes que recibieron la transfusión del tratamiento cuatro días después del diagnóstico (11.9%).
La noticia de la aprobación de emergencia del tratamiento, que revirtió una decisión anterior, se produce en momentos en que se está realizando un amplio y riguroso ensayo científico de alcance nacional para comparar la seguridad y la eficacia del tratamiento con plasma de convaleciente frente a un tratamiento con un placebo en adultos mayores expuestos a la COVID-19. El ensayo doble ciego está patrocinado por los Institutos Nacionales de la Salud (NIH) en Bethesda, Maryland, y el Departamento de Defensa.
“Creo que lo que sabemos hasta ahora es que, en general, el uso del plasma de convaleciente es seguro para las personas con COVID-19 que lo reciben”, dijo Edward “Lalo” Cachay, profesor de Medicina en el Departamento de Enfermedades Infecciosas en la Facultad de Medicina de University of California, San Diego, uno de los sitios del ensayo. "¿Podemos decir con precisión y certeza que es eficaz? ¿Es seguro para las personas que están gravemente enfermas? No contamos con esos datos. No sabemos".

































































También te puede interesar
Cómo los médicos están tratando el coronavirus en este momento
Los esteroides, la pronación y la terapia de plasma son algunas de las opciones actuales.25 maneras inteligentes de protegerte del coronavirus
Cómo evitar el contagio durante la pandemia.Qué esperar si te hospitalizan por COVID-19
Además: preguntas que los pacientes y familiares deberían plantear.