Continúa el retiro de medicamentos contra la acidez estomacal por riesgo de cáncer
Las autoridades federales siguen investigando el daño potencial de un contaminante.
In English | Funcionarios federales informan que tres compañías farmacéuticas están sacando del mercado medicamentos populares contra la acidez que pueden contener "niveles inaceptables" de una sustancia que posiblemente cause cáncer.
Los medicamentos eliminados del mercado, publicados por la Administración de Alimentos y Medicamentos (FDA, en inglés) esta semana, son los más recientes en una serie de retiradas que comenzó en septiembre del 2019, cuando la FDA alertó al público acerca de la presencia de un posible carcinógeno humano, N-nitrosodimetilamina (NDMA), en algunos medicamentos que contienen ranitidina. La ranitidina es la forma genérica de Zantac. Está disponible con o sin receta médica.
El anuncio de la FDA impulsó a las cadenas de farmacias nacionales a quitar rápidamente de la venta sus medicamentos de ranitidina como precaución adicional. Seguidamente, varias compañías farmacéuticas anunciaron retiros voluntarios de sus medicamentos. Y ahora, más de ellas lo están haciendo.
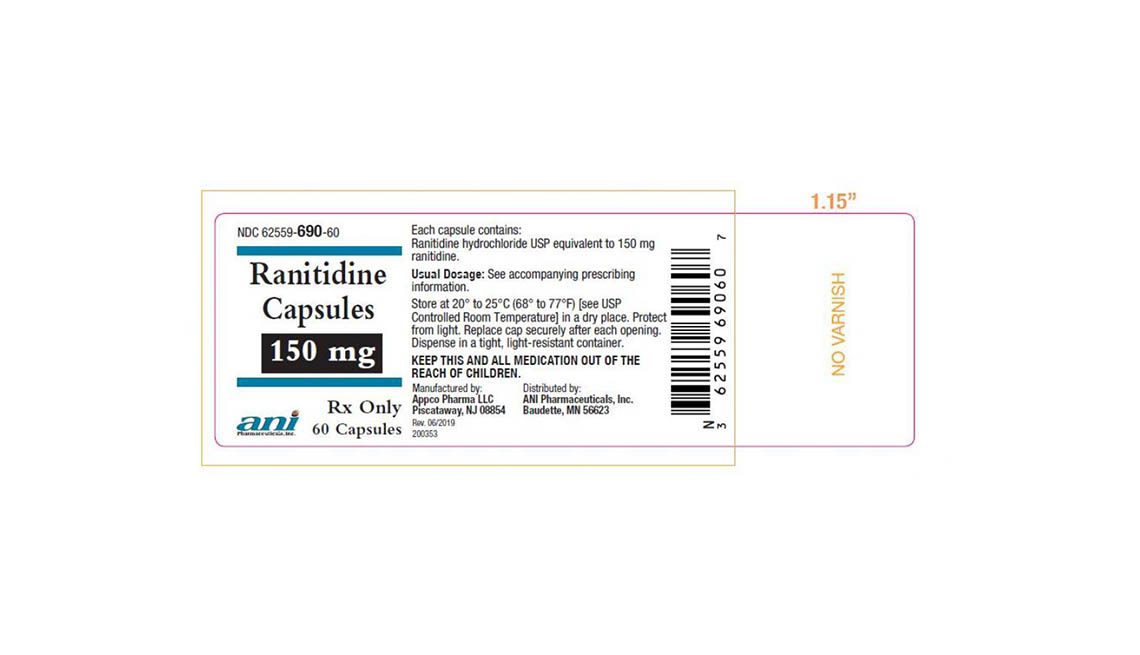
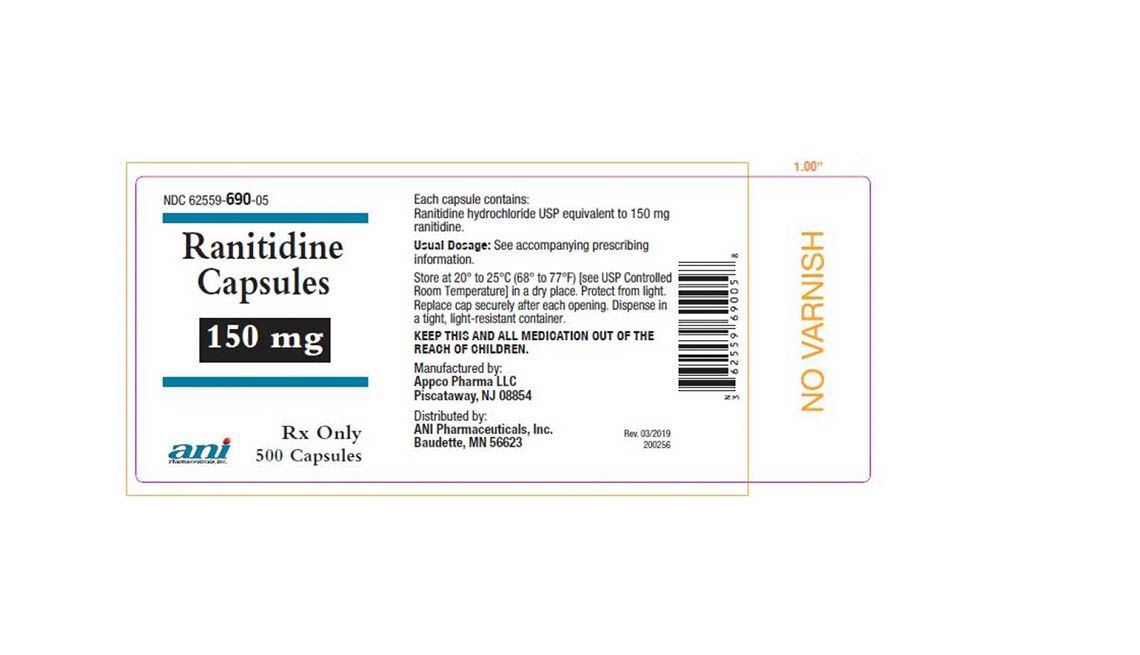
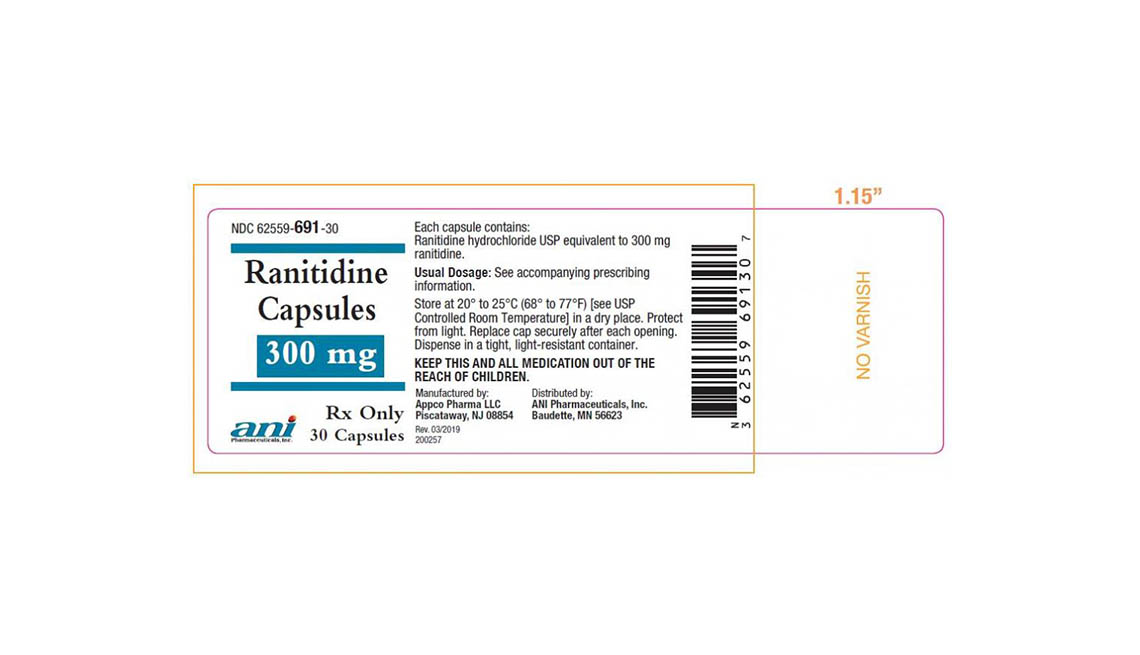
Denton Pharma Inc. está eliminando del mercado todas sus pastillas de ranitidina no vencidas de 150 y 300 milígramos; Appco Pharma está retirando todas sus cápsulas de clorhidrato de ranitidina no vencidas de 150 y 300 milígramos.
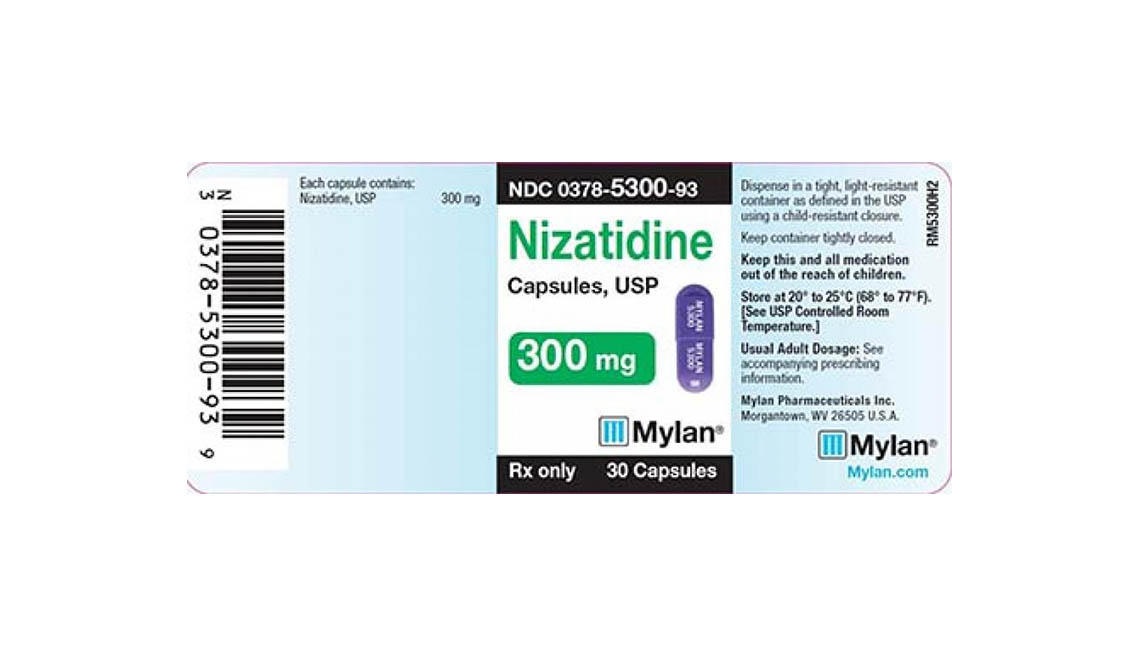
Mylan Pharmaceuticals también anunció esta semana que está sacando del mercado tres lotes de cápsulas de nizatidina, un antiácido empleado para el tratamiento de úlceras y acidez estomacal causadas por la enfermedad por reflujo gastroesofágico.
Todas las compañías mencionaron impurezas de la NDMA o posibles impurezas en las pastillas como el motivo del retiro de los medicamentos, pero indicaron que no se han reportado efectos adversos a la salud hasta la fecha. Se sigue aconsejando a los consumidores que dejen de tomar el medicamento de inmediato.
Recibe contenido similar, suscríbete a nuestro Boletín
Según la FDA, la NDMA es un contaminante ambiental conocido que se suele encontrar en el agua y los alimentos, incluida la carne, los productos lácteos y los vegetales. Recientemente, la agencia inició una investigación para "entender la causa de la presencia de dicha impureza en estos medicamentos".
La FDA también investiga desde el 2018 la presencia de impurezas de la NDMA en otros fármacos, incluidos los medicamentos para la presión arterial y la insuficiencia cardíaca, y actualmente "está evaluando si los niveles bajos de NDMA en la ranitidina presentan un riesgo para los pacientes".
La FDA añade que aquellas personas que estén tomando ranitidina recetada y que deseen dejar de tomarla deben hablar con su proveedor de atención médica acerca de otras opciones de tratamiento. Las pruebas realizadas por el Gobierno no han encontrado NDMA en otros medicamentos comunes para tratar la acidez y las úlceras estomacales, como Pepcid (famotidina), Tagamet (cimetidina), Nexium (esomeprazol), Prevacid (lansoprazol) y Prilosec (omeprazol).
Los cambios en el estilo de vida también pueden ayudar a reducir los síntomas de la acidez estomacal, explica Brian Antono, médico especialista en medicina familiar e investigador de políticas de salud en la Facultad de Medicina de Georgetown University en Washington, D.C.
En una entrevista anterior con AARP, este recomendó limitar el consumo de cafeína, y evitar la comida picante y otros desencadenantes que causan reflujo ácido.
Mylan Pharmaceuticals dice que los consumidores que tienen en su posesión sus productos sacados del mercado (cápsulas de nizatidina de 150 y 300 miligramos con números de lote 3086746, 3082876 y 3082877) deben ponerse en contacto con Stericycle al 888-628-0727 para devolver los medicamentos.
Los consumidores que tengan preguntas sobre la retirada de medicamentos de Appco Pharma deben llamar al 732-253-7735 o enviar un correo electrónico a pv@appcopharma.com. Aquellos que hayan comprado los productos afectados de Denton Pharma pueden llamar al 800-722-0772 para tramitar la devolución del producto.
La FDA advierte que debes consultar a tu médico si observas cualquier problema que pueda estar relacionado con los medicamentos mencionados. Las reacciones adversas se deben comunicar al Safety Information and Adverse Event Reporting Program de la FDA (en inglés).
A continuación se incluyen fotos de los medicamentos retirados.
- |
- Photos