Vida Sana

Leonard Chayrez llamó a su pareja en pánico.
“No podía recordar cómo usar la máquina de tarjetas de crédito en la estación de gasolina, así que conduje a tres”, dice Chayrez, un diseñador floral jubilado de Phoenix. “Olvidaba las cosas”.


Membresía de AARP: $12 por tu primer año cuando te inscribes en la renovación automática.
Obtén acceso inmediato a productos exclusivos para socios y cientos de descuentos, una segunda membresía gratis y una suscripción a AARP The Magazine.
Únete a AARP
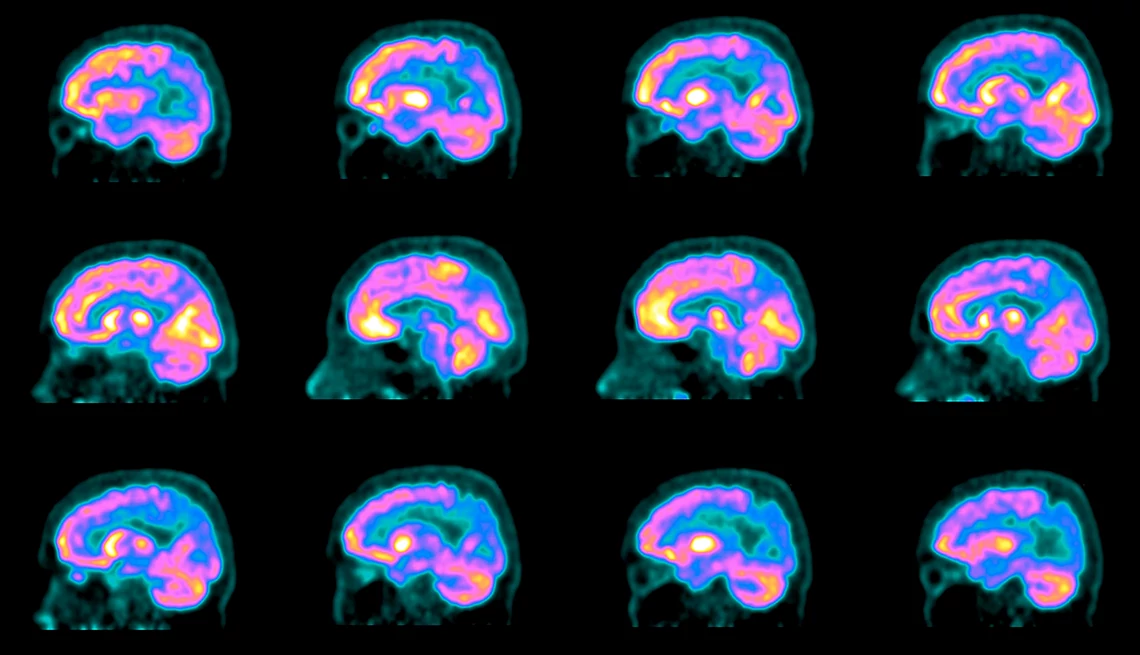
Eso fue en el 2018. Un año después, Chayrez, de 58 años, recibió un diagnóstico de deterioro cognitivo leve, y poco después, de la enfermedad de Alzheimer. Desde junio del 2023, ha recibido dos veces al mes infusiones de lecanemab (LE - qembi), el medicamento que está acaparando titulares y que fue aprobado el año pasado por la Administración de Alimentos y Medicamentos (FDA), que elimina las placas características de Alzheimer en el cerebro y ralentiza la pérdida de memoria. “Creo que tendré más días de felicidad”, dice Chayrez.


La atención y esperanza creadas por el lecanemab da una idea de lo sombrías que eran las perspectivas para los pacientes. No es un medicamento milagroso. No detiene, revierte ni cura este trastorno que te roba la memoria; en promedio, puede retrasar el deterioro mental en solo cinco meses durante un período de tratamiento de 18 meses, dice la investigación. Y viene con una serie de riesgos, incluidos el riesgo de hinchazón del cerebro y sangrado. Los estudios están en curso. Pero a pesar de todos estos inconvenientes, representa un gran avance, una base sobre la que la comunidad médica puede empezar a construir. El neurólogo e investigador de Alzheimer, el Dr. Randall Bateman, lo expresa de esta manera: “Este es el comienzo de la capacidad de tratar y cambiar el curso de la enfermedad de Alzheimer”.
La primera pequeña victoria
Solo los pacientes con la enfermedad de Alzheimer sintomática en etapa temprana y los niveles altos confirmados de proteínas amiloides en el cerebro son candidatos para el lecanemab. En un estudio de Mayo Clinic realizado en la comunidad en el 2023, solo entre el 8 y el 17% de las personas reunían los requisitos según los criterios del ensayo. Y sus costos —se estima que $6,636 al año, incluso con la cobertura de Medicare— son prohibitivos para muchos.
Sin embargo, después de más de 40 años de estudios, decenas de miles de millones en fondos de investigación, al menos 146 medicamentos que no se han aprobado y mucha controversia pública y desesperación privada entre los científicos, la aprobación del lecanemab marca un importante punto de inflexión en la lucha contra la enfermedad de Alzheimer. Es el primer medicamento “que modifica la enfermedad de Alzheimer" en recibir la aprobación tradicional de la FDA y ganar la cobertura estándar de Medicare. Lo más significativo es que el lecanemab es uno de un puñado de avances recientes que se espera —por fin— transformará la manera en que la comunidad médica diagnostica, trata y finalmente previene una de las enfermedades más temidas de Estados Unidos.
“He estado haciendo esto durante 45 años”, dice el geriatra y neurocientífico Howard Fillit, cofundador y director científico de la Alzheimer's Drug Discovery Foundation. “Este es realmente un momento decisivo”.
En los próximos cinco años, los científicos anticipan más avances: análisis de sangre convenientes para diagnosticar la enfermedad de Alzheimer en el consultorio de tu médico; una variedad de medicamentos que pueden atacar la enfermedad en muchos frentes diferentes; y estrategias de estilo de vida personalizadas y comprobadas por la investigación que probablemente se conviertan en estándares de atención.
Según los científicos, en un plazo de 10 años, la enfermedad de Alzheimer se puede manejar en el consultorio de tu médico de la misma manera en que se diagnostican las enfermedades cardíacas y la diabetes, a través de análisis de sangre y podrán tratarse con una combinación de medicamentos y estrategias de estilo de vida. El sueño de los pacientes, los médicos, los investigadores y la sociedad: en lugar de una enfermedad terminal, la enfermedad de Alzheimer podría ser tratable, prevenible e incluso reversible.
No hay tiempo que perder
Es una carrera contra el tiempo. Para el 2030, se proyecta que 8.5 millones de adultos mayores en Estados Unidos tendrán Alzheimer. Medio millón de nosotros lo desarrollaremos este año.
Una vez que comienza, no hay manera de detenerlo. A medida que las células cerebrales mueren, las conexiones entre ellas se debilitan y el cerebro mismo se encoge, la memoria empeora, las habilidades de pensamiento disminuyen y navegar la vida cotidiana se vuelve cada vez menos posible. Al menos un tercio de las personas con Alzheimer en etapa temprana entran en una etapa más grave en unos tres años, lo que hace que el lecanemab y posiblemente otros tratamientos para etapas tempranas estén fuera del alcance. Debido a que la herencia desempeña un papel, muchos de nosotros con antecedentes familiares de Alzheimer hemos mirado hacia el futuro con temor.
Rochelle Long, de 67 años, de Shaker Heights, Ohio, cuida de su madre de 86 años con Alzheimer avanzado mientras trabaja a tiempo completo. Su padre, abuela, cuatro tías y un tío tenían el trastorno. Hasta ahora, ella está bien, pero mantener el optimismo se vuelve difícil. “Las compañías farmacéuticas han gastado una enorme cantidad de miles de millones de dólares a lo largo de los años, ¿y aquí es donde estamos?”. Dice Long. “Es desalentador”.
Incluso los expertos más optimistas están de acuerdo en que el lecanemab en sí no cambiará la situación, pero podría convertirse en parte de un arsenal que sí podría hacerlo. “Por primera vez, podemos cambiar la curva del deterioro cognitivo”, dice la neuróloga de la Facultad de Medicina de Harvard Reisa Sperling, directora del Center for Alzheimer Research and Treatment en Brigham and Women's Hospital en Boston. Sperling está dirigiendo un nuevo estudio que analiza el lecanemab para prevenir la enfermedad de Alzheimer en las personas en riesgo.
“Como neuróloga que trata a pacientes y alguien cuyo padre y abuelo murieron a causa de la enfermedad, creo que vale la pena tener entre cinco y seis meses adicionales de estabilidad relativa e independencia”, dice. “Pero no es lo suficientemente bueno. Necesitamos un gran jonrón".
Y por fin, la comunidad médica puede tener su turno al bate.




































































También te puede interesar
¿Qué tratamientos existen para el Alzheimer?
Hay medicamentos que alivian algunos síntomas, y algunas opciones nuevas podrían demorar las etapas.
5 razones por las que no tenemos una cura para la enfermedad de Alzheimer
Es difícil curar una enfermedad cuando su causa todavía está en debate.
Demencia o Alzheimer: ¿Cuál es?
Cómo entender la diferencia y por qué es importante.